El reglamento MDR de un vistazo
El 26 de mayo de 2021, el Reglamento sobre los productos sanitarios, abreviado «MDR» por las siglas de «Medical Device Regulation» también conocido como Reglamento (UE) 2017/745, sustituyó a las normativas 90/385/CEE y 93/42/CEE, que estaban en vigor hasta ese momento. El nuevo MDR requiere la adaptación y el cumplimiento de ciertas obligaciones y afecta a todos los participantes de la industria. Es aplicable a todos los productos sanitarios, incluidos aquellos ya comercializados.
Objetivos del MDR
- Garantizar una seguridad, fiabilidad y calidad continuas de los productos sanitarios
- Reforzar la transparencia de la información para los usuarios y profesionales del sistema sanitario
- Reforzar la trazabilidad, el seguimiento post-comercialización y la vigilancia
El MDR crea un marco regulador seguro, transparente y duradero reconocido a nivel mundial. Es directamente aplicable en todos los países de la Unión Europea y no sustituye a la legislación nacional.
Requisitos del MDR
Este nuevo reglamento redefine las condiciones y responsabilidades de los distintos participantes. Con anterioridad al MDR, la directiva afectaba únicamente a fabricantes, agentes, montadores, importadores y distribuidores.
De ahora en adelante, el MDR concederá la condición de «agente económico» y las responsabilidades asociadas recaerán sobre todos los participantes en los siguientes sectores industriales:
- Fabricantes, montadores, reempaquetadores, reprocesadores
- Agentes
- Importadores
- Distribuidores
- Agentes de ventas a distancia e internos
- Instituciones sanitarias
El MDR incorpora múltiples cambios, entre los que se incluyen los siguientes:
- Implementación de requisitos esenciales y procedimientos reforzados para el diseño y la fabricación de productos sanitarios
- Aumento de los requisitos para la obtención del marcado CE y para los organismos notificados responsables de evaluar la conformidad y la certificación. Los organismos notificados tienen especificaciones ampliadas y se encuentran bajo el control europeo.
- Designación de una persona responsable de garantizar el cumplimiento con el reglamento. A dicha persona se le confía la responsabilidad de garantizar la conformidad de los productos sanitarios, proporcionar la documentación técnica y actualizar la declaración de conformidad de la EU.
- Reforzar la vigilancia en la comunicación y gestión de incidentes, el seguimiento post-comercialización y la gestión de los datos del seguimiento clínico post-comercialización.
- Implementación de una base de datos europea dedicada a los productos sanitarios (EUDAMED). La Comisión Europea espera que su lanzamiento tenga lugar en el segundo trimestre de 2027.
EUDAMED permitirá a los usuarios y profesionales del sistema sanitario acceder a información relativa a los productos sanitarios comercializados en Europa, así como consultar los incidentes comunicados y el progreso de las investigaciones clínicas. Se asignará un identificador único (IUD o UDI) a cada producto sanitario para mejorar su trazabilidad.
- Implementación de un sistema de identificación única para los productos sanitarios (UDI, por las siglas en inglés de Unique Device Identifier o identificador único de producto), que aparecerá en el envase del producto en forma de código de barras o código QR. El UDI brindará una trazabilidad altamente precisa, lo que resulta útil en caso de producirse un incidente o retirarse un producto del mercado. Hay un calendario independiente con planes de implementación para el segundo trimestre de 2029.
Calendario del nuevo reglamento y su impacto en los productos sanitarios Compat
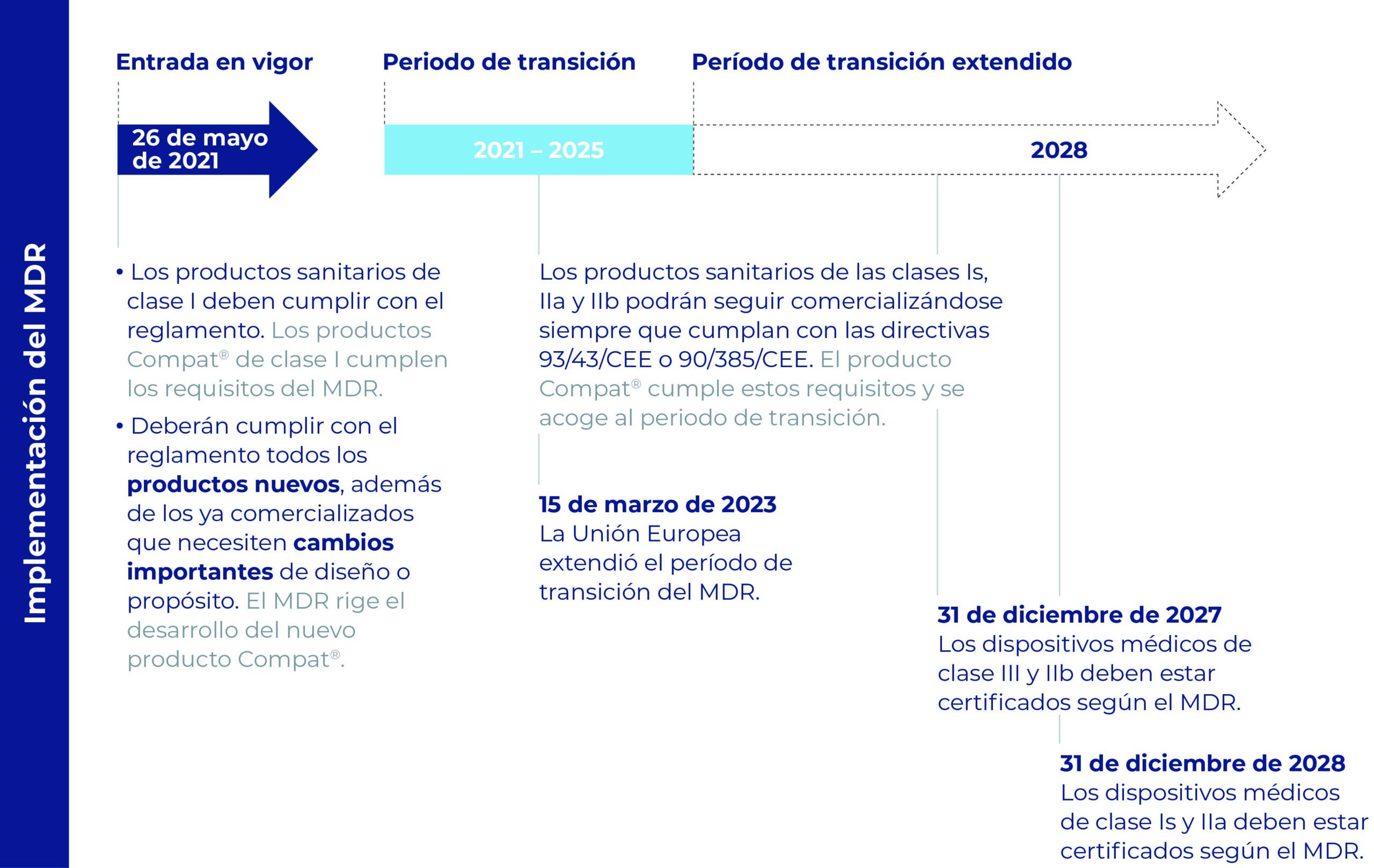
¡La gama Compat está lista!
Todos los productos de la gama Compat se están fabricando conforme a los requisitos del MDR para las fechas aplicables:
- el 26 de mayo de 2021 para los productos sanitarios de clase I
- la fecha de vencimiento del certificado CE o no más tarde del:
– 31 de diciembre de 2027 para los dispositivos de clase IIb
– 31 de diciembre de 2028 para los dispositivos de clases Is y IIa.
Para obtener más información, póngase en contacto con su delegado Compat o utilice el formulario de contacto



