Una panoramica sull’MDR
Il 26 maggio 2021 è entrato in vigore un nuovo regolamento europeo relativo ai dispositivi medici. Il regolamento 2017/745, conosciuto anche come “Regolamento relativo ai dispositivi medici” o semplicemente “MDR”, sostituisce le precedenti direttive 90/385/CEE e 93/42/CEE. Tale regolamento richiede a tutte le parti interessate del settore di rispettare determinati obblighi e si applica a tutti i dispositivi medici, compresi quelli già immessi sul mercato.
Obiettivi dell’MDR
- Garantire sicurezza, efficacia e qualità costanti dei dispositivi medici
- Rendere più trasparenti le informazioni per utenti e professionisti in ambito sanitario
- Rafforzare la tracciabilità, la sorveglianza e la vigilanza post-commercializzazione
L’MDR crea un quadro legislativo di riferimento solido, trasparente e duraturo riconosciuto in tutto il mondo. Può essere applicato direttamente in tutti i Paesi dell’Unione europea (UE), senza essere trasposto nella legislazione nazionale.
Requisiti dell’MDR
Il nuovo regolamento ridefinisce gli status e le responsabilità delle parti interessate nel settore. Mentre le leggi precedenti si applicavano solo a produttori, mandatari, assemblatori, importatori e distributori, l’MDR riconosce lo status di “operatore economico” e le relative responsabilità a tutte le parti interessate nel settore:
- Produttori, assemblatori, riconfezionatori, ricondizionatori
- Agenti
- Importatori
- Distributori
- Forze di vendita interne e a distanza
- Istituti sanitari
L’MDR apporta diversi cambiamenti, tra i quali citiamo, a titolo esemplificativo e non esaustivo:
- Introduzione di requisiti essenziali e rafforzamento delle procedure per la progettazione e la fabbricazione dei dispositivi medici.
- Aumento dei requisiti necessari per ottenere la marcatura CE e dei requisiti per gli organismi notificati che valutano conformità e certificazione. Il campo d’azione degli organismi notificati è ora più ampio e questi sono controllati dall’UE.
- Nomina di un referente designato incaricato di garantire la conformità al regolamento. Questa persona è responsabile della conformità dei dispositivi medici, fornisce la documentazione tecnica necessaria e aggiorna la dichiarazione di conformità UE.
- Potenziamento della vigilanza in merito alle segnalazioni di incidenti e della gestione delle stesse, della sorveglianza post-commercializzazione e della gestione dei dati di follow-up clinico post-commercializzazione.
- Creazione di un database europeo dedicato esclusivamente ai dispositivi medici (EUDAMED). La Commissione europea prevede di lanciare il database nel secondo semestre 2027.
EUDAMED consentirà agli utenti e ai professionisti del settore sanitario di avere accesso alle informazioni sui dispositivi medici commercializzati in Europa ed esaminare gli incidenti segnalati nonché i progressi delle indagini cliniche. A ogni dispositivo medico sarà assegnato un identificativo unico del dispositivo (UDI) per migliorarne la tracciabilità.
- Creazione di un sistema di identificazione univoca per i dispositivi medici (UDI: Unique Device Identifier), che comparirà sulla confezione del prodotto sotto forma di codice a barre o codice QR. Questo sistema consentirà un accurato monitoraggio dei dispositivi medici, che tornerà utile in caso di incidenti o richiami di prodotti. È stato stilato un calendario a parte che prevede l’adozione di questo sistema a partire dal secondo trimestre 2029.
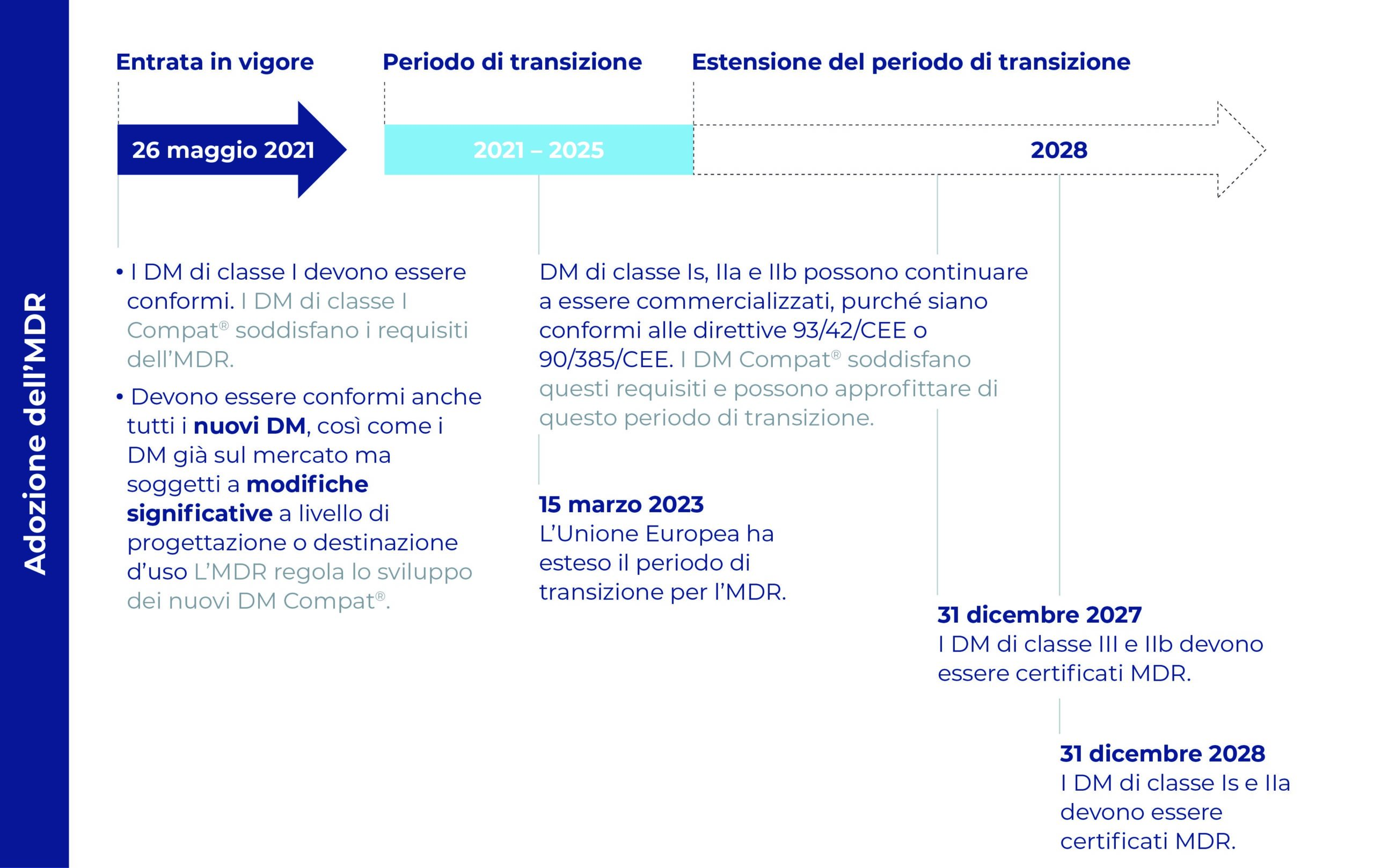
Il calendario per l’adozione del nuovo regolamento e il suo impatto sui dispositivi medici (DM) Compat
La gamma Compat è pronta!
Tutti i prodotti Compat saranno resi conformi ai requisiti dell’MDR entro le date previste:
- Il 26 maggio 2021 per i dispositivi medici di classe I.
- Allo scadere del certificato CE, e comunque non oltre il:
– 31 dicembre 2027 per i dispositivi di classe IIb
– 31 dicembre 2028 per i dispositivi di classe Is e IIa.
Contattaci per ulteriori informazioni



